電池の基本構成と充放電の原理:知っておきたい 電池の仕組み(2)(2/6 ページ)
電池は2種類の金属と電解液から構成されます。では、この構成からどのようにして電気を発生し、電池となるのでしょうか。
放電反応の仕組み
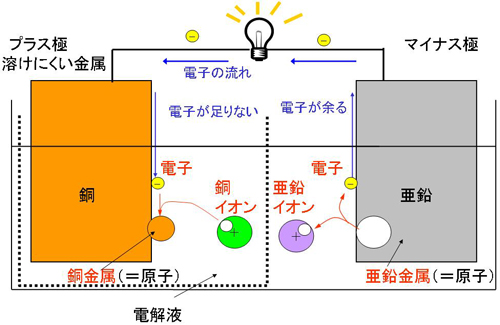
電池の放電反応を、亜鉛と銅の金属を用いたダニエル電池で考えてみます。
まず、電解液に溶けやすい金属(亜鉛)を電解液に浸けると、亜鉛が電解液に溶けて、イオン状態になります。陽イオンは電子が少ない状態なので、電子が余ることになります。余った電子の逃げ場が無ければ、反応はすぐに止まってしまいますが、プラス極と電線がつながっていれば、電子が電線を通ってプラス極まで流れていくことができます。
一方、プラス極では、流れてきた電子と電極の周りにあるイオンが結びついて原子に戻る反応が起こります。電極の周りには銅イオンが存在し、電子と結合し、金属となります。
ダニエル電池では、プラス極の周りに銅イオンがあるので、銅が析出しましたが、ボルタ電池では、水素イオンしか存在しないので水素ガスが発生します。水素ガス(水素分子)も原子の集まりなので、同じような反応となるわけです。よって金属が溶けるというのはガスが溶け込む、金属が析出するというのはガスが発生するということと同じ意味になります。
充電反応の仕組み
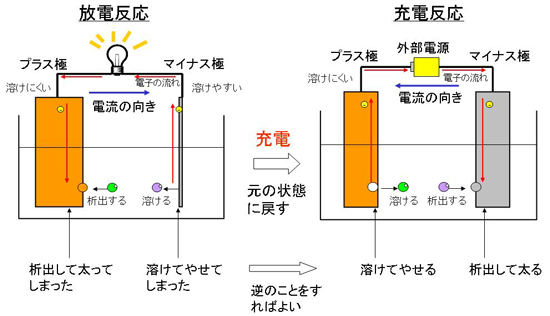
電池を放電していくとマイナス極である溶けやすい金属が溶けていくので、次第に電極の金属がなくなってしまい、金属が全部溶けてしまうと反応できなくなってしまいます。
一次電池では、ここで電池を交換するしかありませんが、二次電池では、充電することで元の状態に戻すことができます。元に戻すためには、逆向きに電流を流します。そうすると、プラス極で金属が溶けてイオンとなり、マイナス極でイオンが金属となって析出します。
ここで、プラス極は溶けにくい金属、マイナス極は溶けやすい金属なので、溶けにくい金属を溶かし、溶けやすい金属を元に戻すという、自然には起こらない反応を起こさなければなりません。よって、無理やりに電流を流すために、充電にはエネルギーが必要になるというわけです。
Copyright © ITmedia, Inc. All Rights Reserved.