電池の基本構成と充放電の原理:知っておきたい 電池の仕組み(2)(3/6 ページ)
電池は2種類の金属と電解液から構成されます。では、この構成からどのようにして電気を発生し、電池となるのでしょうか。
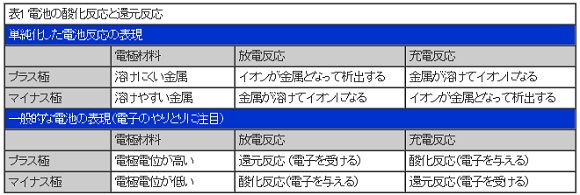
酸化反応と還元反応
実際の電池では、金属が溶ける、析出するという単純なものだけではありません。例えば、鉛電池の放電時のプラス極は、金属が析出するのではなく、酸化鉛が溶けて鉛イオンとなります。これは、酸化鉛中の鉛は、もともと電子が4つ少ないイオンの状態であり、電子を結合しても電子が2つ少ないイオンのままであるためです。
このように、電池の反応の形態はさまざまですが、金属やイオンの状態は関係なく、電子のやりとりだけを注目すれば良いことになります。
つまり、放電時は、マイナス極では電子を与える反応(これを酸化反応という)、プラス極では電子を受ける反応(これを還元反応という)、充電時はそれぞれその逆の反応が起こることになります。
水系電解液と非水系電解液
充電反応は、放電の逆反応を起こすだけですが、実際には簡単ではありません。それは、電解液はイオンを含むので、そのイオンも反応するためです。
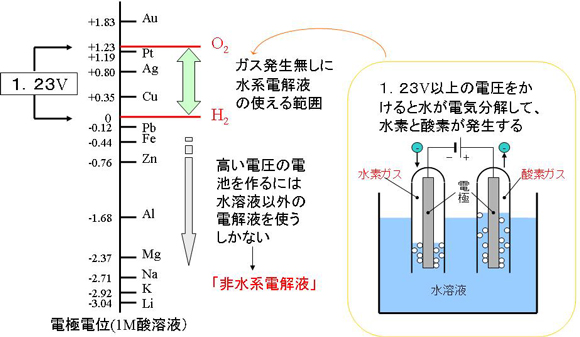
例えば、水溶液には水素イオンと水酸化イオンが含まれています。理論的には、水に1.23V以上の電圧を与えると水の電気分解が起こり、酸素と水素が発生します。充電とは電池の中に電圧をかける行為なので、電解液に水溶液を使った電池に、1.23V以上で充電すると水が電気分解される現象が生じてしまいます。
理論的な状態からずれることはありますが、おおむね水溶液を使った二次電池の電圧の限界値は1.23Vになります。ニカド電池やニッケル水素電池の電圧が約1.2Vというのはこの制限から生じるものです。
一次電池は充電をしませんが、自らの電圧で電解液の分解が生じてしまうため、やはり、あまり大きな電圧にすることはできません。
それでは、高い電圧の電池とするにはどうすれば良いでしょうか。水の電気分解の呪縛を解くためには、水以外のものを使えば良いわけです。そこで考え出されたのが、非水電解液系電池です。これは、まさしく「水に非ず」の、有機溶媒系の電解液を用いたものです。水の電気分解が起こらないため、3V以上の高い電圧の電池を作ることができます。
Copyright © ITmedia, Inc. All Rights Reserved.