アルミ電解コンデンサー(4)―― 電解液、組み立て、再化成:中堅技術者に贈る電子部品“徹底”活用講座(37)(1/3 ページ)
前回に引き続いて電解液、素子の組み立て、そして再化成までを説明していきます。
前回はアルミ電解コンデンサーの主要工程である酸化膜の生成を中心に説明しました。エッチング工程などを含めると電子部品の工程とは思えないほどの化学薬品の列挙に戸惑いを覚えた方も多かったのではないでしょうか?
でも実際にコンデンサーを使う側に立ってみれば必要な知識は薬品うんぬんではなく、『化学反応を利用して作られているので温度や雰囲気に注意が必要な部品だ』という点に尽きます。
今回は前回に引き続いて電解液、素子の組み立て、そして再化成までを説明していきますが、以前の稿で説明したアルミ電解コンデンサーの製造工程や各部の機能については必要に応じて参照してください。
電解液
電解液の役割
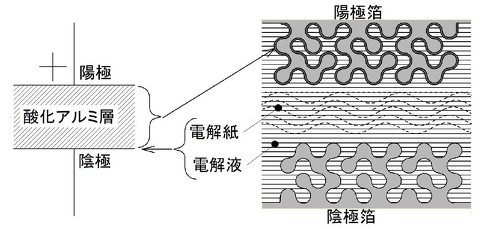
ここまで繰り返し述べてきたようにアルミ電解コンデンサーの容量は図1の機能構成図に示す酸化膜部分に発生します。しかし酸化膜は電極箔に開けられた微細なピット表面に作られていますので機械的な接触ではこの酸化膜の広大な表面積を有効に利用できません。一方、導電性の液体であれば図1に示すようにピット内部に浸透して容量を有効に引き出すことができます。
このように酸化膜(誘電体)に実際に接触しているのは電解液であり、この観点から電解液を「真の陰極」とも呼ぶこともありますが、電解液のままでは扱いにくいので陰極箔まで電荷を導いて外部へ取り出します。これが外部リードの負極となり、こちらは「見かけの陰極」とも呼ばれています。電解液の働きにはこの導電性の他にも後述する酸化膜の自己修復作用があります。
電解液の成分
もともと液体の体積抵抗値が液体の汚染度の指数として使われることから分かるように、イオン成分を含んでいない液体は導電性ではなく導電性を得るには何らかのイオンが液体中に存在していることが必須の条件になります。例えば導電性の海水にはNaClが溶けていますが、これらは(Na++OH-)と(H++Cl-)という塩基と酸の組み合わせが各イオンとして水中に溶けていると考えることができます。
なお、海水のように何かが溶け込んでいる液体を溶液と言い、溶けている物質(NaCl)を溶質、水(H2O)に該当するものを溶媒(主剤)と言い、表1によく使われる電解液の溶媒と溶質を挙げます。
またアニオンは酸ですからアルミ缶の腐食防止策として電解液のpHを調整して中性化する目的でカチオン(塩基)を混入します(四級塩電解液も中性化されています)。
| 主として使われる成分 | ||
|---|---|---|
| ベースとなる液体(溶媒) | エチレングリコール/エチレングリコールモノメチルエーテル モノメチルエーテル/γ-ブチロラクトン/N-メチルホルムアミド |
|
| 溶けている物質(溶質) | アニオン (酸:陰イオン) |
アジピン酸/マレイン酸/ベンゾイック酸/フタル酸/サリチル酸 |
| カチオン (塩基:陽イオン) |
アンモニア/アンモニア水/トリエチルアミン 水酸化テトラメチルアンモニウム |
|
このように電解液の導電性の源(みなもと)は溶けている溶質ですので完全導体ではなく、ジュール損を発生させる抵抗成分を電解液のESR(Equivalent-Series-Resistance:等価直列抵抗)として表します。
この電解液には図1に示すように交流電流(リップル電流)が通りますが、このESR成分によって電解液は発熱し電解液の蒸発が加速されます。電解液が蒸発すると電解液と酸化膜との接触面積が減少して特性が劣化して寿命となりますので高リップル品は寿命その他の特性を満たしながらESRを特に低くするように各成分が調合され、一方で長寿命品は表2に示すように溶質濃度を高くして溶媒の蒸発を防ぐように調合されています。
| タイプ | 外 観 | 電気伝導率 (mS/cm、30℃) |
溶質濃度 (wt%) |
|---|---|---|---|
| 汎用 | 黄褐色液状 | 約13 | 25 |
| 長寿命対応 | 淡黄色〜黄褐色液状 | 約10〜11 | 60 |
| 約 4 | 60 | ||
| 高リップル対応 | 黄褐色液状 | 約14 | 35 |
| 三洋化成ニュース 2011 初夏 No.466より抜粋 | |||
アニオン(酸)には表1のカルボン酸類以外にもホウ酸などの弱酸が用いられ、コンデンサーの定格電圧によって各種成分を変えています。これは酸成分が電解液の酸化膜修復能力に関係しているためであり、現状では全ての製品に使える「万能の電解液はない」のが実情です。
酸:水溶時にH+イオンを出し、自身は−イオンになる物質
塩基:水溶時にOH−イオンを出し、自身は+イオンになる物質。以前はpHの区分でアルカリと呼ばれていましたがイオン供給の区分ではアルカリと厳密には一致しません。
なお、"塩"とは食塩のように酸と塩基の中和反応などによって生成された化合物であり、塩基とは異なります。
Copyright © ITmedia, Inc. All Rights Reserved.