電池の基本構成と充放電の原理:知っておきたい 電池の仕組み(2)(1/6 ページ)
電池は2種類の金属と電解液から構成されます。では、この構成からどのようにして電気を発生し、電池となるのでしょうか。
前回、電池の基本構成の中で、電池は2種類の金属と電解液から構成されると説明しました。この構成からどのようにして電気を発生し、電池となるかを説明します。
充放電の原理
イオンと起電力
電池は2種類の金属と電解液から構成されます。この2種類の金属とは、一方は電解液に溶けやすい金属、もう一方は電解液に溶けにくい金属で、電解液は金属を溶かす液といえます。十円玉と一円玉の電池では、一円玉が溶けやすい金属、十円玉が溶けにくい金属になります。
それでは、金属が電解液に溶けやすいとはどういうことでしょうか。物質は原子から構成されます。金属も原子の集まりであり、原子核にあるプラス電荷と電子のマイナス電荷がつりあっている状態です。これが、電解液に溶けるとイオンという状態になります。
イオンは原子核のプラス電荷に対して、電子のマイナス電荷が少ない状態で、正確には陽イオンと呼びます。逆にマイナス電荷が多いイオンもあり、これを陰イオンと呼びます。電池では陽イオンが反応の主体となることが多いので、ここでは、単にイオンといえば陽イオンを指すとしておきます。金属が電解液に溶けてイオンの状態となると同時に電子を生み出すため、電気を発生させることができます。
溶けやすい金属とはイオンになりやすい金属のことであり、このイオンになりやすさのことを「イオン化傾向」と呼びます。イオンになりやすさは金属と電解液によって決まります。イオン化傾向は、「電極電位」として数値であらわすことができます。
イオン化傾向が大きいということは、電極電位がよりマイナスであるということです。2種類の金属の電極電位の差、つまり溶けやすさの差で電池の電圧が定まり、これを「起電力」と呼びます。より溶けやすい金属とより溶けにくい金属で電池を作れば高い電圧の電池を作ることができます。
Copyright © ITmedia, Inc. All Rights Reserved.

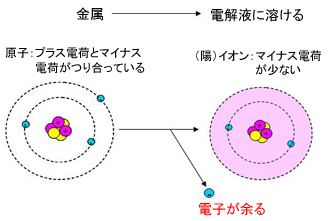 図1 金属とイオン
図1 金属とイオン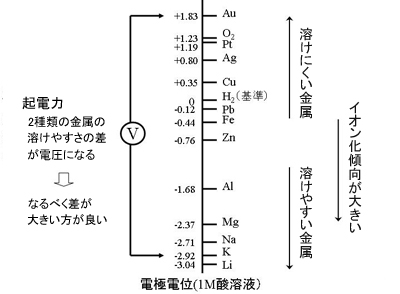 図2 イオン化傾向と電極電位
図2 イオン化傾向と電極電位


