ポータブルがん検出器に見る回路設計の指針:NMR分光の応用で低コスト化に成功(1/4 ページ)
人体におけるがんの発生を正確に診断する場合には、手間もコストもかかる免疫組織化学染色検査を行うことが多い。ハーバード大学とマサチューセッツ総合病院は、NMR分光を応用することにより低コストのポータブルがん検出器を開発した。本稿ではまず、NMR分光の原理を簡単に説明する。その上で、このがん検出器に用いた電子回路について詳しく紹介する。
がん検査は手間とコストがかかる
医師が人体におけるがんの発生を正確に診断する際には、診断対象となっている部分の組織を採取し、抗原抗体反応によってがん細胞特有のタンパク質を検出する免疫組織化学染色検査を行うのが一般的だ。しかしこの検査手法は、専門の技術者が、診察室や手術室とは別の場所にある検査室で実施する必要があるため時間とコストがかかる。そこで、ハーバード大学の電子機器設計研究所(Electronic Instrument Design Laboratory)とマサチューセッツ総合病院(Massachusetts General Hospital)は、診察室などの現場におけるがん細胞検査の実現とともに大幅な低コスト化も視野に入れた、ポータブル(持ち運び可能な)がん検出器を開発した。
このがん検出器は、がん細胞特有のタンパク質を検出するために、核磁気共鳴(NMR: Nuclear Magnetic Resonance)分光を用いている。NMR分光は分光分析手法の1つで、原子核のスピン歳差運動を引き起こしてその結果を計測するものだ。マサチューセッツ総合病院 システム生物学(Systems Biology)センターの研究者であるHakho Lee氏とDavid Issadore氏は、通常はかなり大型になるNMR分光分析装置を医療現場に持ち込めるくらいに小型化する方法を探っていた。
Lee氏は、がん特有のタンパク質をNMR分光によって検出する手法を開発した。ただしこの手法を装置化したところ、数々の装置を詰め込んだラックが必要になってしまった。筆者が、このポータブルがん検出器の開発プロジェクトで担当したのは、ラックに入った装置の数々から成るシステムを、書籍大の筐(きょう)体の中に組み込めるような電子回路を設計することだった。
今回のポータブルがん検出器に用いるNMR分光ユニットには、20M〜30MHzの範囲で正確に制御したRFパルスを、電子回路から生成する必要がある。また、最初のパルスと次のパルスの位相についても、正確に制御しておかなければならないのだ。
NMR分光の原理
電子回路に対するこれらの要件を理解するためには、NMR分光に関する一定の予備知識が必要だろう。ここからはNMR分光の原理を簡単に説明する。
NMR分光は、原子核のスピン歳差運動を利用して分子構造を解析する測定技術である。説明を分かりやすくするため、NMR分光でも最も広く利用されている、分子に結合している水素核(プロトン:1H)の状態を測定できる1H-NMR(プロトンNMR)を例に挙げて解説しよう。まず、プロトンを、電荷が均一に分布した球体と考える。プロトンのスピンは、プロトンのある一定速度の回転として理解できる。この回転によってすべての電荷が円状に動いているので、ソレノイドのコイルを流れる電流と同様に磁場が発生する。核磁気モーメントと呼ばれる各プロトン固有の磁場は、外部から印加された磁場と同じ方向に並ぶ傾向がある。
地球ゴマが、ジャイロ効果の摂動によって重力のかかっている方向を中心にして歳差運動を起こすように、磁場が存在する中でプロトンに一定の周波数のバースト状のRF(高周波)パルスを与えると、プロトンの核磁気モーメントはそれと同じ周波数で歳差運動を起こす。この周波数はラーモア(Larmor)周波数と呼ばれており、プロトンの周囲にかかっている磁場の強さの関数で表される。1896年にこのラーモア周波数を発見した、アイルランドの物理学者/数学者Joseph Larmorは、磁場の中の磁気モーメントが磁場に沿って並ぶ傾向についても予想している。プロトンの核磁気モーメントの歳差運動が減衰して再び外部の磁場に沿って並ぶときに、プロトンに照射されたRFパルスに相当するエネルギーが放出される。
プロトンだけでなく他の原子核についても、陽子と中性子を合計した数(質量数)が奇数であれば、固有のラーモア周波数で歳差運動を起こす。例えば、プロトンのラーモア周波数は42.58MHz/T(テスラ)である。Tは磁場の強さを表す単位であり、1Tは1万ガウスに相当する。1ガウスは地球の磁場の強さとほぼ等しい。プロトン以外であれば、窒素核のラーモア周波数が3.09MHz/Tとなっている。一般によく知られた元素である酸素や炭素は、質量数が偶数であるため磁気スピンが存在しない。このため、NMR分光では酸素や炭素は検出できない(ただし、炭素の場合、同位体である質量数が13の炭素は検出できる)。
ある分子に対して1H-NMRによる分光測定を行うと、水素核に近接している原子の影響によってラーモア周波数からわずかにずれる。このずれ(化学シフト)を利用することにより測定対象の分子構造を分析できる。NMR分光の測定精度は、このラーモア周波数のわずかなずれを正確に解読できるかどうかにかかっていると言ってもよい。なお、ラーモア周波数は周囲の磁場の関数である。このことは、NMR分光を行う際に、均一で安定した磁場を発生させる必要があることを示している。
1H-NMRで印加するRFパルスからは、プロトンのラーモア周波数の他にスピン歳差運動の減衰に関連する2つの時定数を求めることができる。プロトンはRFパルスによって摂動が与えられた後、時定数T1で緩和して熱平衡状態に戻る。周囲に存在するスピンとの相互作用によっても時定数T2での減衰が発生する。
このT2は、分子中におけるプロトンの周囲の磁気環境、すなわち分子の構成を表している。また、磁場の不均一な部分に関する情報も含んでいる。磁場の不均一な部分が大きいほど、ラーモア周波数への干渉が強くなり、スピン歳差運動によって発生する信号波形の減衰は早くなる。たとえ磁場が注意深く制御されていたとしても、この不均一な部分の影響はプロトンの周囲の磁気環境に関する特異な情報を完全に覆い隠してしまうのだ。しかし、この問題は、スピンエコー法という簡潔な手法を使って解決できる。以下にスピンエコー法について説明する。
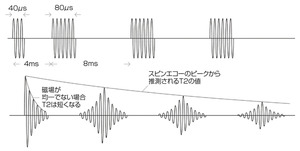
まず、十分なエネルギーを持つRFパルスを印加し、プロトンの核磁気モーメントが起こす歳差運動の中心軸を磁場に対して90度倒す。最初は、歳差運動はすべて同じ位相で起るので、放出されるエネルギーは最大である。しかし、ほとんどすぐに周辺のラーモア周波数によって歳差運動の位相がずれ始める。数ms後には位相のずれが最大に達し、その結果放出されるエネルギーは小さくなる。
次に、最初のパルスの2倍の波長を持つRFパルスを印加する。最初のパルスによって核磁気モーメントは90度回転するので、2回目のRFパルスではさらに180度回転することになる。さて、次に何が起きるだろうか。最初のRFパルスで位相がずれる過程を理解するために、顔の前で閉じた扇をゆっくりと開くところを想像してほしい。このとき、扇の右手側は速い核磁気モーメントを示し、左手側は遅い核磁気モーメントを示す。2回目のRFパルスを印加すると扇はひっくり返る。つまり、速いモーメントは左手側になり、遅いモーメントを追いかけ始める。最終的には扇は閉じられる。
この手順を、歳差運動が完全に減衰するまで繰り返すことにより、スピンエコー信号のピークの減衰率から正確なT2の値が得られる(図1)。
マサチューセッツ総合病院のLee氏とIssadore氏は、NMR分光分析装置を持ち運びできるようにするためにMRS(Magnetic Relaxation Switch:磁気緩和スイッチ)という分析手法を採用した。MRSでは、磁気を帯びたナノ粒子を結合させた抗体(がんと関連するタンパク質と結合する性質を持つ)を用いる。これらの抗体は対象となるタンパク質を見つけると凝集するので、抗体と結合したナノ粒子の磁気によってタンパク質を構成する原子のスピン緩和時間T2が大幅に短縮する。このT2の変化を分析することによってがんの発生を診断できるようになるのだ。
Copyright © ITmedia, Inc. All Rights Reserved.